膜片钳技术基本原理与特点:膜片钳技术本质上也属于电压钳范畴,两者的区别关键在于:①膜电位固定的方法不同;②电位固定的细胞膜面积不同,进而所研究的离子通道数目不同。电压钳技术主要是通过保持细胞跨膜电位不变,并迅速控制其数值,以观察在不同膜电位条件下膜电流情况。因此只能用来研究整个细胞膜或一大块细胞膜上所有离子通道活动。目前电压钳主要用于巨大细胞的全性能电流的研究,特别在分子克隆的卵母细胞表达电流的鉴定中发挥着其他技术不能替代的作用。该技术的主要缺陷是必须在细胞内插入两个电极,对细胞损伤很大,在小细胞如神经元,就难以实现,又因细胞形态复杂,很难保持细胞膜各处生物特性的一致。膜片钳使用操作流程及注意事项:拉制仪提前预热(至少30min)。神经生物学膜片钳全细胞记录设计公司
膜片钳实验系统:根据不同的电生理实验要求,可以组建不同的实验系统,但有若干共同的基本部件,包括机械部分(防震工作台、屏蔽罩、仪器设备架)、光学部分(显微镜、视频监视器、单色光系统)、电子部件(膜片钳放大器、刺激器、数据采集的设备、计算机系统)和微操纵器在大多数膜片钳实验,要求所有实验仪器及设备均具有良好的机械稳定性,以使微电极与细胞膜之间的相对运动尽可能小。防震工作台放置倒置显微镜和与之固定连接的微操纵器,其他设备置于台外。屏蔽罩由铜丝网制成,接地以防止周围环境的杂散电场对膜片钳放大器的探头电路的干扰。仪器设备架要靠近工作台,便于测量仪器与光学仪器配接。神经生物学膜片钳全细胞记录设计公司膜片钳使用的注意事项:为了防止尘埃、静电伤害机器,每天做实验前请用清水拖地。
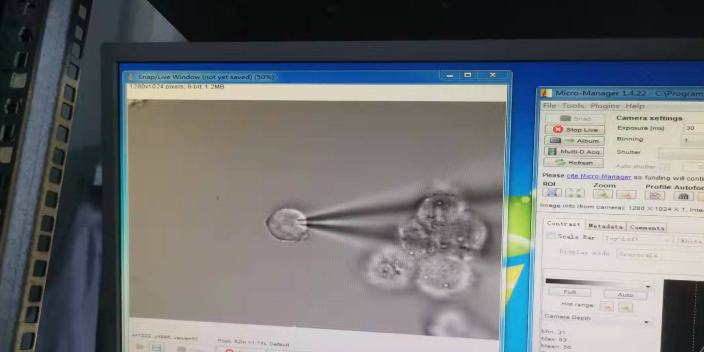
膜片钳技术的基本原理和方法:膜片钳使用的基本方法是,把经过加热抛光的玻璃微电极在液压推进器的操纵下,与清洁处理过的细胞膜形成高阻抗封接,导致电极内膜片与电极外的膜在电学上和化学上隔离起来,由于电性能隔离与微电极的相对低电阻(1~5MΩ)只要对微电极施以电压就能对膜片进行钳制,从微电极引出的微小离子电流通过高分辨、低噪声、高保真的电流-电压转换放大器输送至电子计算机进行分析处理。膜片钳技术实现的关键是建立高阻抗封接,并能通过特定的记录仪器反映这些变化。
一种电生理膜片钳灌流装置的制造方法:为了测量在不同药物对细胞中的离子通道的影响,通常需要在膜片钳实验中实施灌流。例如,需要检验某种是否对某种离子通道的影响,则需要在细胞封接后记录电流数据,然后通过在细胞周围快速给药再次记录电流数据即可对比数据判断该对离子通道的影响。以往多采用橡皮泥等简单设备固定灌流管进行实验,经常出现灌流管固定不良影响实验的情况,也有精密的灌流装置,但是结构复杂,且成本非常高。膜片钳技术是在电压钳技术基础上发展起来的。膜片钳放大器是整个实验系统中的中心,它可用来作单通道或全细胞记录。
膜片钳技术的基本原理是通过负反馈使得膜电位与指令电压相等,在电压钳制的条件下记录膜电流。上面是电阻反馈式膜片钳放大器的电路示意图。A1为一极高输入阻抗、极低噪声的场效应管运算放大器,由于A1极高的开环增益使得两个输入端的电压几乎完全相等,使用膜片钳全细胞记录技术观察拮抗剂对烟碱受体激动剂量效曲线的影响,从而实现电压钳制。Rf为一数值可切换的反馈电阻,分别对应于不同的电流记录范围,其中高值反馈电阻具有极高的电阻和极低的杂散电容,是决定放大器单通道记录性能的基本元件。膜片钳技术的建立,对生物学科学特别是神经科学是一资有重大意义的变革。神经生物学膜片钳全细胞记录设计公司
膜片钳系统有如下应用局限性:光能应用于悬浮细胞的纪录。神经生物学膜片钳全细胞记录设计公司
膜片钳技术在通道研究中的重要作用:利用膜片钳技术还可以用于药物在其靶受体上作用位点的分析。如神经元烟碱受体为配体门控性离子通道,膜片钳全细胞记录技术通过记录烟碱诱发电流,可直观地反映出神经元烟碱受体活动的全过程,包括受体与其激动剂和拮抗剂的亲和力,离子通道开放、关闭的动力学特征及受体的失敏等活动。使用膜片钳全细胞记录技术观察拮抗剂对烟碱受体激动剂量效曲线的影响,来确定其作用的动力学特征。然后根据分析拮抗剂对受体失敏的影响,拮抗剂的作用是否有电压依赖性、使用依赖性等特点,可从功能上区分拮抗剂在烟碱受体上的不同作用位点,即判断拮抗剂是作用在受体的激动剂识别位点,离子通道抑或是其它的变构位点上。神经生物学膜片钳全细胞记录设计公司